Das Wichtigste in Kürze
Unter der Dichteanomalie ist die absolute Ausnahme gemeint, die Wasser im Vergleich zu anderen Stoffen zeigt:
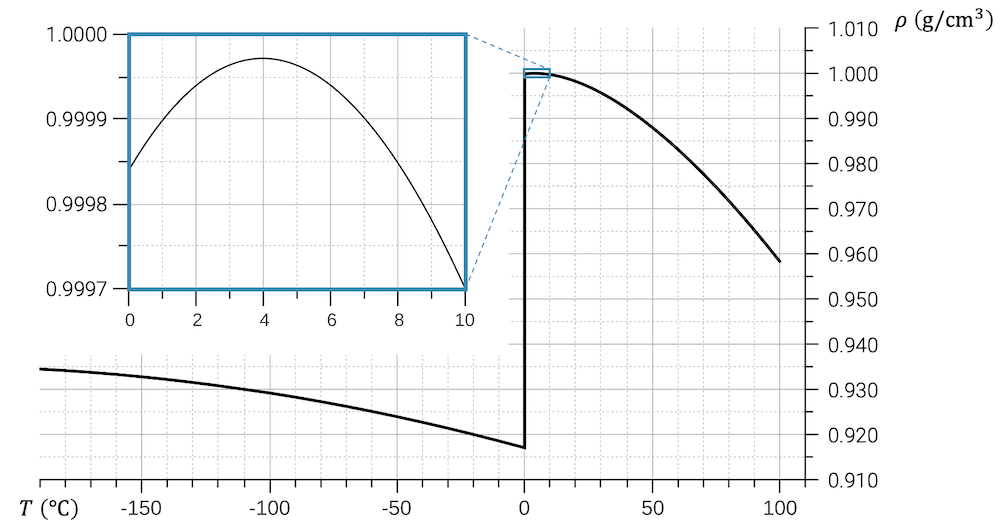
Wasser hat eine maximale Dichte bei einer Temperatur von 4°C:
\[ \rho(4^\circ\text{C}) = 1.00\;\text{g}/\text{cm}^3 \]
Bei Temperaturen von 4°C bis 0°C nimmt die Dichte wieder ab.
\[ \rho(0^\circ\text{C}) = 0.9999\;\text{g}/\text{cm}^3 \]
Festes Wasser (Eis) hat eine noch kleinere Dichte als flüssiges Wasser von 0°C, wodurch Eis auf dem Wasser schwimmt. Bei allen anderen Stoffen sinkt der Feststoff wegen seiner höheren Dichte in seiner eigenen Flüssigkeit immer ab.
\[ \rho_{\text{Eis}}(0^\circ\text{C}) = 0.92\;\text{g}/\text{cm}^3 \]
Weil die Dichte von Wasser bei Temperaturen unter 4°C kleiner ist, steigt kühles Wasser auf und vereist oben an der Oberfläche. Mit zunehmender Tiefe zeigen Gewässer eine zunehmende Temperatur bis 4°C am tiefsten Punkt. Dadurch wird eine fortschreitende Vereisung so stark verlangsamt, dass Lebewesen den Winter überleben können.
Video
Häufigste Fragen
“Das Wasser ist aus physikalischer Sicht ein ganz spezieller Stoff, der sich von allen anderen Stoffen unterscheidet.”
Dichteanomalie – Warum Eis schwimmt
Wasser hat eine Eigenschaft, die sich von allen anderen Stoffen unterscheidet. Es bildet eine grosse Ausnahme in der Welt von Millionen von Stoffen, die wir kennen. Diese Ausnahme wird Anomalie des Wassers benannt und sie betrifft die Volumenausdehnung von Wasser und Wassereis.
Gemäss dem Teilchenmodell, der Bewegung der Teilchen und deren Messung mit Hilfe der Temperatur, dehnen sich Stoffe mit steigender Temperatur immer mehr aus. Das bedeutet auch, dass sie mit sinkender Temperatur immer weniger Raum einnehmen und ihre Dichte immer grösser wird.
Das Wasser tut das auch für Temperaturen oberhalb von 4°C.
Wird die Temperatur unter 4°C gesenkt, nimmt die Dichte wieder ab, d.h. bei 4°C haben wir ein Dichtemaximum von knapp unter 1.0000 \(\text{g}/\text{cm}^3\).

Wird das Wasser dann fest, ist die Dichte deutlich kleiner: Das ist auch der Grund, warum Eis schwimmt.
Alle anderen Stoffe verhalten sich anders: Erstarrte Festkörper sinken in ihrer Flüssigkeit ab oder beim Abkühlen wird ein “normaler” Stoff von unten her fest.
Die kristalline Struktur des Eises ist eine Wissenschaft für sich. Es gibt verschiedene mögliche Kristallstrukturen, je nach Druck. Dichtes Eis, das z.B. bei hohem Druck in Gletschern entsteht, ist dichter als flüssiges Wasser.
Das Eis, das wir aber im Eiswürfel haben, hat eine kleinere Dichte als flüssiges Wasser. Der Grund liegt in der hexagonalen Anordnung, die speziell viel Platz braucht. Das Wasser bevorzugt diese Anordnung aufgrund der starken Polarität des Moleküls und der Wasserstoffbrücken, die zwischen den Wasserstoffatomen und den Sauerstoffatomen des Nachbarmoleküls bestehen.
Flüssiges Wasser erlaubt den beweglichen Wassermolekülen eine zusätzliche Annäherung, was zu einer grösseren Dichte bei 4°C führt.
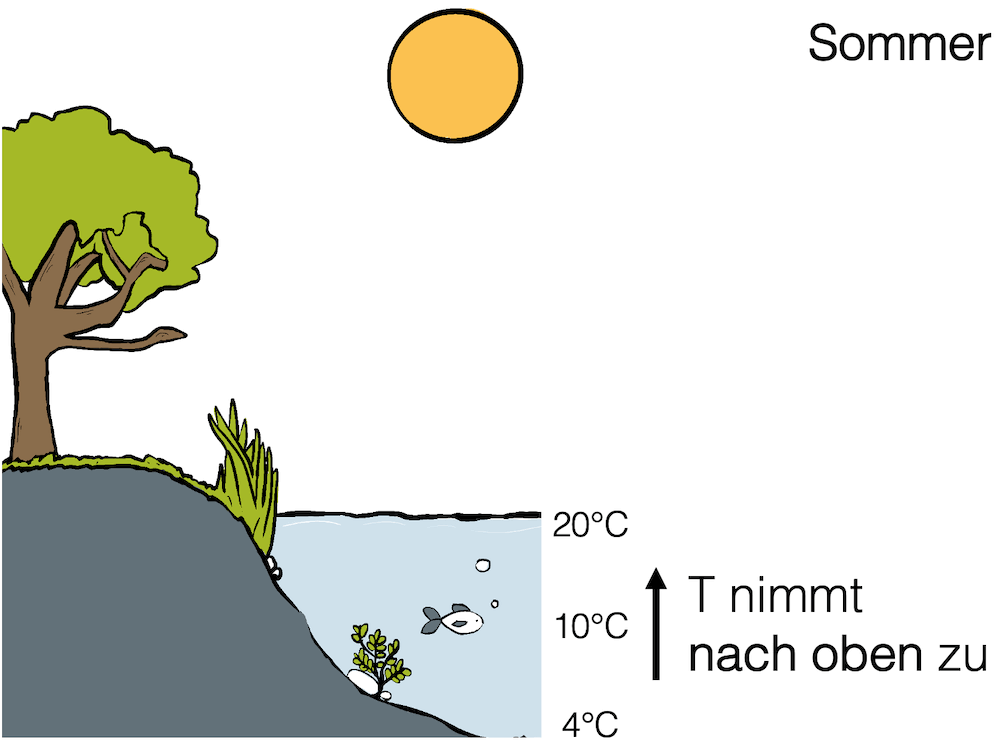
Temperaturgradient in Gewässern im Sommer
Wenn draussen die Sonne brennt, erwärmt sie die Erde. Das Wasser erwärmt sich weniger schnell, weil es eine besonders grosse spezifische Wärmekapazität hat. Die Wasseroberfläche erwärmt sich aber schon. Sie erwärmt sich als Erste. Je weiter unten im Wasser, desto tiefer sinkt die Temperatur.
Kaltes Wasser sinkt immer mehr ab, weil es eine grössere Dichte hat, als wärmeres Wasser.
Sehr kaltes Wasser (unter 4°C) ist leichter als 4-grädiges Wasser und steigt deshalb ein bisschen auf. Auf dem Grund (z.B. eines Sees) haben wir das dichteste Wasser 4 °C, nicht das Kälteste.
“In nördlichen Breiten ist die Wasseranomalie der Grund, warum Lebewesen im Wasser überhaupt überwintern können.”
Temperaturgradient in Gewässern im Winter
Im Winter verliert alles Material an Wärme an die Umgebung. Das Wasser kühlt sich ebenfalls von oben her ab, bis es 0°C erreicht und der See zufriert. ❄
Im Gewässer haben wir jetzt Wassertemperaturen zwischen 0°C und 4°C. Das dichteste Wasser ist wieder das 4-Grädige, das am dichtesten ist.
Kälteres Wasser steigt im Winter auf und gefriert durch weiteres Abkühlen an die Oberfläche. Das Eis bleibt oben und schliesst den See gegen zusätzliches Abkühlen ab. In der Tiefe behält das Wasser seine 4°C und bewahrt die Fische vor dem Einfrieren.
Wir haben jetzt einen umgekehrten Temperaturverlauf, mit der höchsten Temperatur unten und der tiefsten Temperatur oben.

Was würde passieren, wenn das Wasser sich “normal” verhalten würde?
Im Winter würde die kalte Luft das Wasser an der Oberfläche abkühlen. Dieses würde dichter werden und somit absinken. Auf dem Grund des Sees würde die Temperatur somit immer weiter absinken, bis das erste Eis entsteht.
Jedes Eis würde auf den Grund absinken und den See langsam von unten auffüllen. Das noch verbleibende “warme” Wasser würde immerzu an die Oberfläche aufsteigen und dort durch die kalte Luft abgekühlt werden.
Das Gewässer würde von unten her komplett und relativ schnell zufrieren.
Ohne Anomalie des Wassers wäre ein Überwintern in solchen Gewässern für Lebewesen unmöglich!
Simulation
Unter dem folgenden Link kann eine Simulation aufgerufen werden. Du kannst hier eindrücklich beobachten, wie Wasser-Moleküle im festen Zustand (Eis) mehr Platz einnehmen, als flüssiges Wasser.
https://phet.colorado.edu/sims/html/states-of-matter-basics/latest/states-of-matter-basics_all.html
Aufgabensammlung
(zu diesem Thema gibt es noch keine Aufgaben)
Lernziele
- Dir ist bewusst, dass alle möglichen Stoffe im Normalfall die höchste Dichte als Feststoff haben. Deshalb sinken Feststoffe in ihrer eigenen Flüssigkeit immer ab. Wasser ist hier eine grosse Ausnahme.
- Du weisst, dass Wasser bei einer Temperatur von 4 °C die höchste Dichte aufweist. Insbesondere weisst du, dass Eis eine kleinere Dichte hat als flüssiges Wasser, was macht, dass Eis aufschwimmt.
- Du kannst in eigenen Worten erklären, warum die Anomalie des Wassers, Leben in freien Gewässern im Winter überhaupt erst möglich macht.
Weitere Links
Dichteanomalie (Wikipedia)
publiziert:
überarbeitet:
publiziert:
überarbeitet:
Schreib deine Frage / Kommentar hier unten rein. Ich werde sie beantworten.





Schreibe einen Kommentar
Du musst angemeldet sein, um einen Kommentar abzugeben.