Inhalt
Das Wichtigste in Kürze
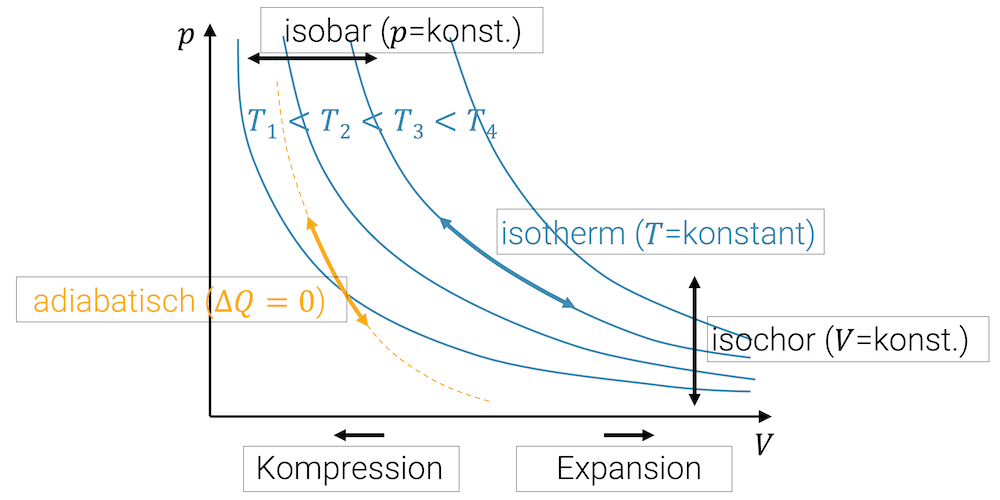
Spezielle Zustandsänderungen
- isobare Kompression oder Expansion (konstanter Druck)
- isotherme Kompression oder Expansion (konstante Temperatur)
- isochore Erwärmung oder Abkühlung (konstantes Volumen)
- adiabatische Zustandsänderung (ohne Austausch von Wärme)
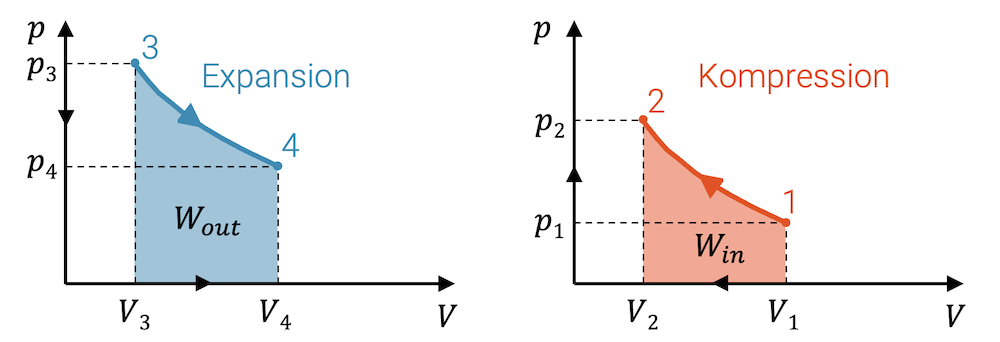
Bei einer beliebigen Zustandsänderung, bei welcher das Fluid komprimiert wird, entspricht die Fläche unter der Linie der Zustandsänderung im p-V-Diagramm der eingebrachten Kompressionsarbeit \(W_{in}\), die am Fluid dafür verrichtet worden ist.
Wird das Fluid entspannt und gibt es dabei Expansionsarbeit ab, so kann diese Arbeit \(W_{out}\) ebenfalls als Fläche im p-V-Diagramm abgelesen werden.
Tutorial Videos
Für das Verständnis von Wärmekraftmaschinen (WKM), Kältemaschinen und Wärmepumpen sind die Zustandsänderungen das A und O. Es geht hierbei um Änderungen von Temperatur, Volumen oder Druck von Gasen, wobei wir uns oft an den Gasgesetzen der idealen Gasen orientieren werden.
Die folgenden Betrachtungen gelten aber nicht nur für ideale Gase, sondern auch für reale Gase, Gas-Flüssigkeitsgemische und Flüssigkeiten. Wir werden deshalb allgemeiner einfach von Fluiden reden.
Spezielle Zustandsänderungen
Eine reale Zustandsänderung ist meistens eine komplexe Angelegenheit. Wenn wir beispielsweise mit der Fahrradpumpe Luft in die Reifen pressen, dann erfährt die Luft eine Zustandsänderung, die nicht so einfach zu fassen wäre. Sie wird komprimiert, d.h. der Druck steigt sicherlich an. Gleichzeitig wird sie aber auch erwärmt, d.h. die Temperatur nimmt ebenfalls zu. Auch wenn die Luft als ideales Gas angesehen werden kann, so ist die Zustandsänderung dieser Luft nicht einfach zu berechnen, denn im Reifen ändern sich \(p\), \(T\) und \(n\) und schliesslich auch \(V\), denn wir drücken die in der Pumpe die eingeschlossene Luft zusammen und verkleinern ihr Volumen \(V\).
Unter speziellen Zustandsänderungen verstehen wir vereinfachte, ideale Fälle, die uns die Anwendung der Gasgesetze erlauben. Es sind dies:
Spezielle Zustandsänderungen
- isobare Kompression oder Expansion (konstanter Druck)
- isotherme Kompression oder Expansion (konstante Temperatur)
- isochore Erwärmung oder Abkühlung (konstantes Volumen)
- adiabatische Zustandsänderung (ohne Austausch von Wärme)
Zustandsänderungen im p-V-Diagramm
Wir können einen Zustand eines Gases mit den Zustandsgrössen \(p\), \(T\) und \(V\) beschreiben. Eine Möglichkeit dazu ist das p-V-Diagramm.
Die beiden Zustandsgrössen \(p\) und \(V\) bestimmen als Koordinaten den Punkt des Zustands im p-V-Diagramm.
Wie steht es mit der Temperatur? Wenn das Gas ideal ist, können wir diese Temperatur mit der idealen Gasgleichung berechnen:
\[ pV = nRT \quad \rightarrow \quad T =\frac{pV}{nR} \]
Wenn es kein ideales Gas ist, weicht die Temperatur vom idealen Wert ab, ist aber auch eine Funktion von \(p\) und \(V\), auch wenn die Funktionsgleichung meistens unbekannt ist.
\[ T=T(p,V) \]
Daraus folgt, dass jedem Punkt im p,V-Diagramm auch eine bestimmte Temperatur zugeordnet werden kann. Wir können uns das wie bei einer Landkarte vorstellen: Jeder Ort im Gelände hat zwei geografische Koordinaten und eine Höhe.
Im p-V-Diagramm ist es genauso. Wir schauen von oben auf eine “Landschaft”, in welcher die Punkte mit den drei Koordinaten \((p,V,T)\) definiert sind. Natürlich gilt das nur für eine bestimmte Menge des Gases, d.h. das Diagramm gilt für 1 kg oder für 1 mol des Gases.
Wenn wir nun den Zustand des Gases ändern, verschiebt sich dieser Punkt auf der “Karte” und ändert dabei meist auch seine “Höhe”. In anderen Worten: Durch eine Veränderung des Drucks und des Volumens ändert sich auch die Temperatur.
Beispiel
-
- Kompression
- Expansion
- isobar
- isotherm
- isochor
- adiabatisch
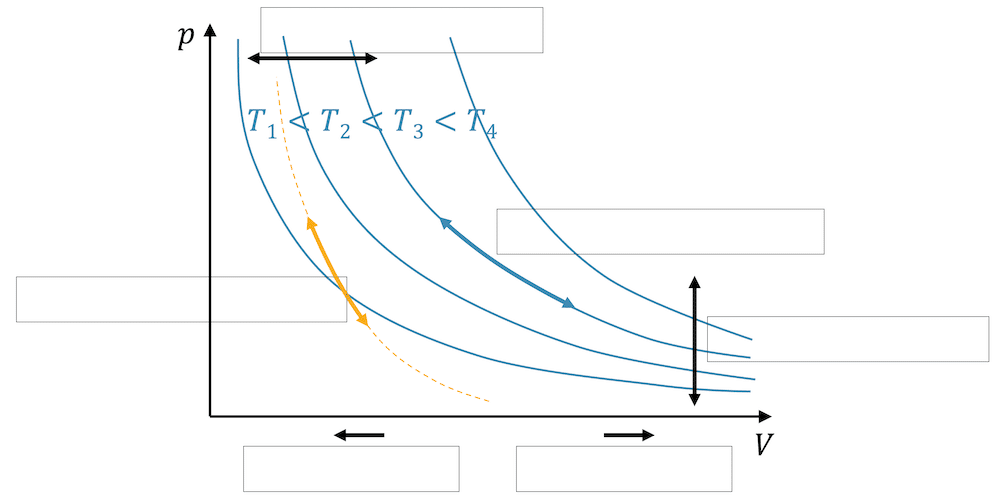
Darstellung von Arbeit im p,V-Diagramm
Wenn wir ein eingeschlossenes Fluid sich leicht expandieren lassen, sinkt der Druck nur minimal. Lassen wir nur eine infinitesimal kleine Expansion zu, d.h. unendlich wenig, so sinkt der Druck dermassen wenig, dass wir näherungsweise einen konstanten Druck \(p\) annehmen können.
Die infinitesimal kleine Arbeit \(\Delta W_i\), die das Fluid dabei verrichtet (oder abgibt), berechnet sich als Produkt von Kraft \(F\) und Weg \(\Delta s\):
\[ \Delta W_i = F \cdot \Delta s \]
Die Kraft entspricht dem Produkt von Fläche und Druck: \(F=p \cdot A\)
\[ \Delta W_i = (p \cdot A) \cdot \Delta s \]
Das Produkt \(A \cdot \Delta s\) entspricht dem kleinen Volumen \(\Delta V\), das durch die Expansion hinzugekommen ist.
\[ \Delta V = A \Delta s \quad \rightarrow \quad \Delta W_i = p \cdot \Delta V \]
Somit haben wir für die infinitesimale Expansionsarbeit \(\Delta W_i\) eine infinitesimal schmale Fläche im p-V-Diagramm:
\[ \Delta W_i = p \cdot \Delta V \]
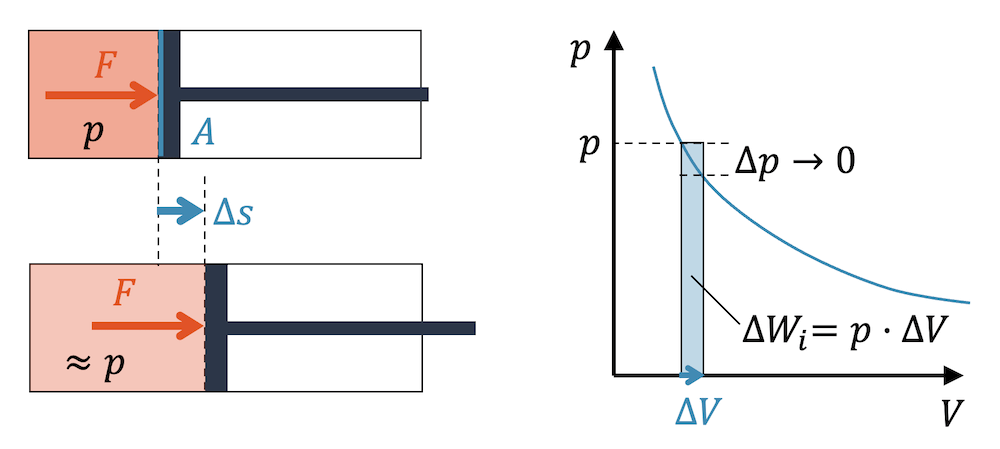
Im p-V-Diagramm ist \(p \cdot \Delta V\) eine Rechteckfläche mit Breite \(\Delta V\) und Höhe \(p\).
Wenn wir vom Zustand 3 zum Zustand 4 expandieren, bewegt sich der Punkt entlang der Kurve der Zustandsänderung. Addieren wir unendlich viele Rechtecke auf dem Weg von 3 nach 4, erhalten wir die Fläche unterhalb der Kurve der Zustandsänderung. Diese Fläche entspricht der Summe aller kleinen Arbeitsbeiträge, d.h. in Summe die Arbeit, die bei der Expansion das Fluid abgibt.
\[ W_{out} = \sum_i \Delta W_i \]
Eine solche unendliche Summe von infinitesimal schmalen Rechtecken heisst Integral und wird mit einem schlanken, grossen “S” für “Summe” geschrieben. Statt einem \(\Delta W\) benutzt man dann auch ein \(dW\):
\[ W_{3\rightarrow 4} = \int_3^4 dW \]
\[ W_{out} = \int_{V_3}^{V_4} p(V) \; dV \]
\[ W_{out} \approx \sum_i \Delta W_i \quad \rightarrow \quad W_{out} = \int_{V_3}^{V_4} p(V)\;dV \]
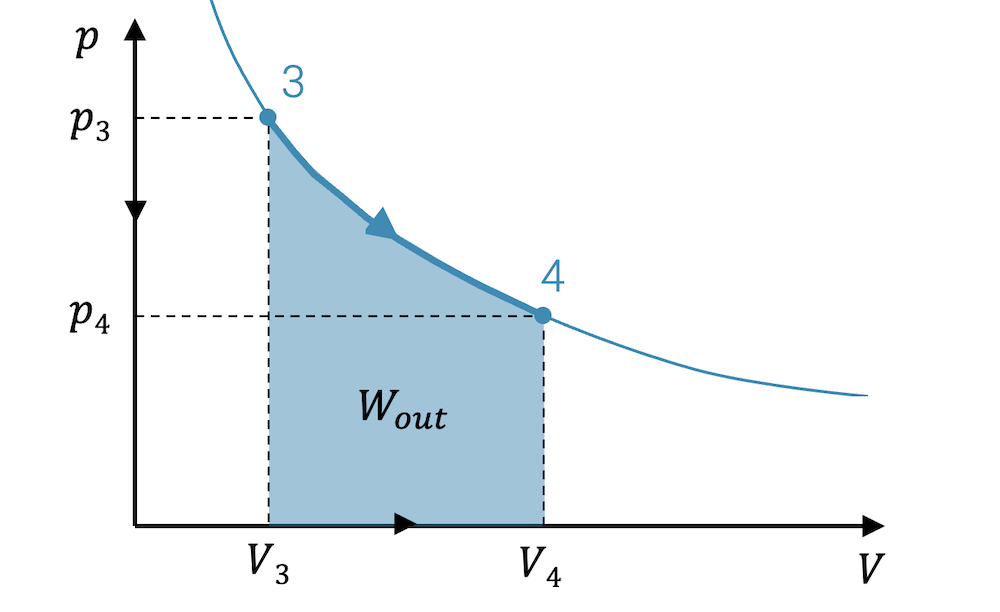
Wenn die Expansion von 3 nach 4 die Arbeit \(W_{out}\) abgibt, dann können wir uns auch den umgekehrten Fall denken: Wir komprimieren es von 1 nach 2.
\[ W_{in} \; = \;- \int_1^2 p(V) \; dV \]
Für die Kompression wird die sog. Kompressionsarbeit dem Fluid zugeführt. Beachte, dass das Integral von rechts nach links gerechnet wird bzw. dass das kleine Volumen \(dV\) bzw. \(\Delta V\) negativ ist. Dadurch ist das ganze Integral negativ. Da wir für die Arbeit einen positiven Wert haben möchten, haben wir vor das Integral ein Minuszeichen gesetzt.
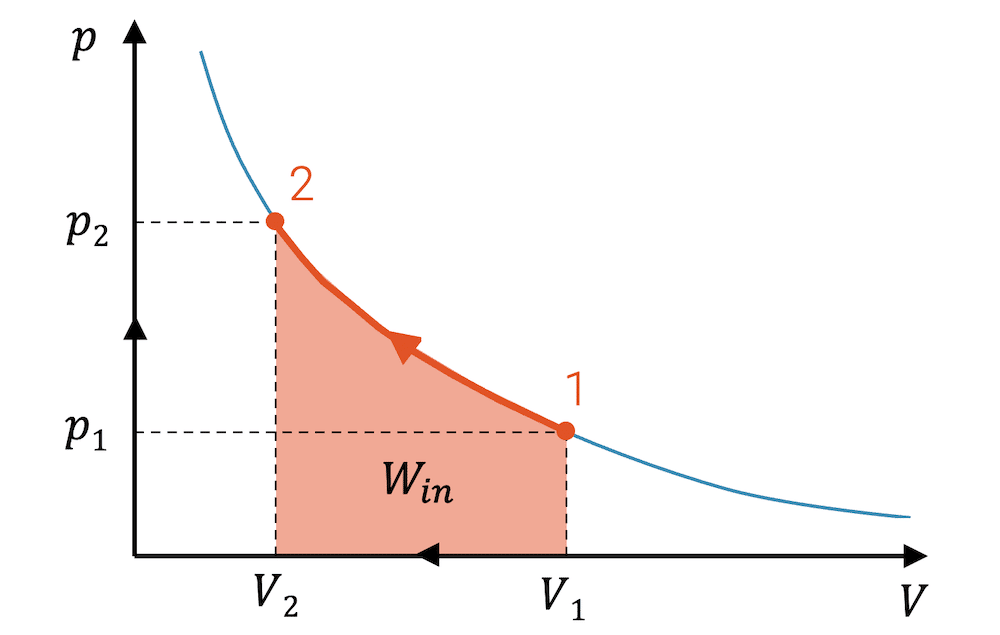
Bei einer beliebigen Zustandsänderung, bei welcher das Fluid komprimiert wird, entspricht die Fläche unter der Linie der Zustandsänderung im p-V-Diagramm der eingebrachten Kompressionsarbeit \(W_{in}\), die am Fluid dafür verrichtet worden ist.
Wird das Fluid entspannt und gibt es dabei Expansionsarbeit ab, so kann diese Arbeit \(W_{out}\) ebenfalls als Fläche im p-V-Diagramm abgelesen werden.
Arbeit von Kreisprozessen
In Wärmekraftmaschinen (WKM) durchläuft ein Fluid einen sog. Kreisprozess, in welchem am Ende das Fluid wieder in den anfänglichen Zustand geführt wird.
Einen solchen Kreisprozess erhalten wir, indem wir z.B. die folgenden Zustandsänderungen durchlaufen:
- 1 ➝ 2 : Isotherme Kompression (\(W_{in}\))
- 2 ➝ 3 : Isochore Wärmeaufnahme
- 3 ➝ 4 : Isotherme Expansion (\(W_{out}\))
- 4 ➝ 1 : Isochore Wärmeabgabe
Im p-V-Diagramm sieht das dann so aus:
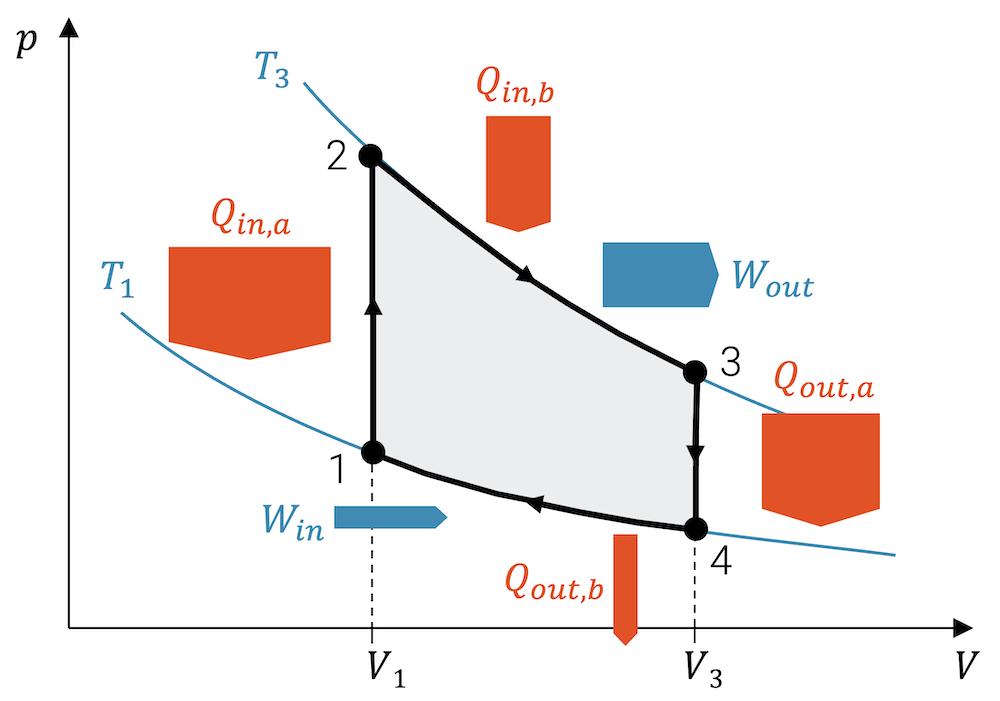
Beachte, dass bei isochoren Zustandsänderungen (\(V\) konstant) keine Arbeit aufgenommen oder abgegeben wird.
Wenn wir uns nun die durch den Kreisprozess eingeschlossene Fläche anschauen, dann entspricht sie der Differenz der vom Fluid abgegebenen und aufgenommenen Arbeit:
\[ W_{out}^{(netto)} \; = \; W_{out} – W_{in} \]
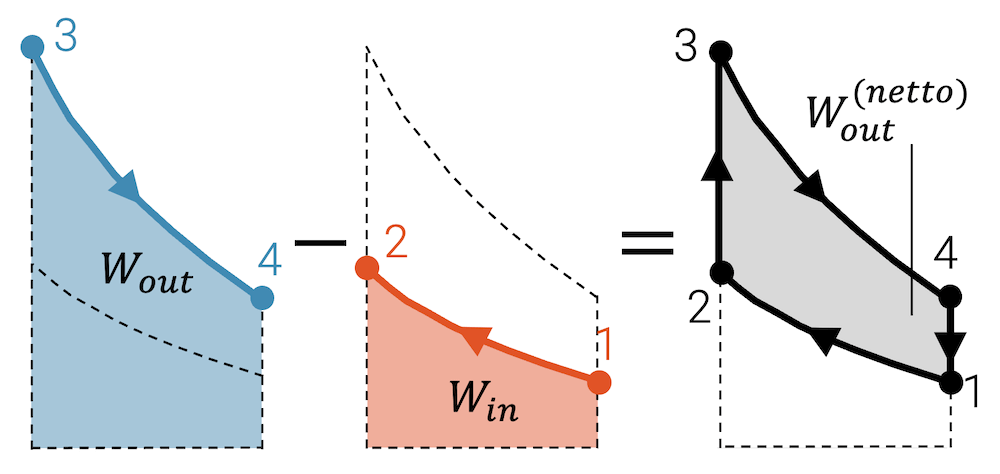
Wenn mehr Arbeit abgeführt als eingebracht wird, dann ist das energetisch eigentlich nicht möglich oder nicht nachhaltig. Allerdings werden ja in den Zustandsänderungen 2 \(^\rightarrow\) 3 und 4 \(^\rightarrow\) 1 Wärme aufgenommen bzw. abgegeben. Insgesamt muss die Bilanz der Energieströme stimmen und die Wärmekraftmaschine muss gleich viel Energie aufnehmen, wie sie abgibt. Die eingeschlossene Fläche zeigt uns aber die wichtigste Grösse der Wärmekraftmaschine, nämlich wie viel Arbeit sie abgibt. Das ist nämlich auch ihr Job. Wärmekraftmaschinen dienen dazu, Arbeit abzugeben, die sie zuvor in Form von Wärme aufgenommen haben.
Die eingeschlossene Fläche zeigt bei einem Kreisprozess (Uhrzeigersinn im p,V-Diagramm) die Netto-Arbeit, die das Fluid abgibt.
Weitere Videos
Aufgabensammlung
Mini-Test
Um Zugang zum Mini-Test zu kriegen,
musst du vollwertiges Mitglied im Hacker-Club sein.
publiziert:
überarbeitet:
publiziert:
überarbeitet:
Schreib deine Frage / Kommentar hier unten rein. Ich werde sie beantworten.
Inhalt










Schreibe einen Kommentar
Du musst angemeldet sein, um einen Kommentar abzugeben.