Inhalt
Das Wichtigste in Kürze
Der Erste Hauptsatz der Thermodynamik (Wärmelehre) besagt: Die Zunahme der inneren Energie \(\Delta U\) eines Systems ist wegen der Energieerhaltung gleich der Summe von netto zugeführter Arbeit \(W\) und netto zugeführter Wärme \(Q\):
\[ \Delta U = W + Q \]
Wird insgesamt mehr Arbeit \(W\) oder Wärme \(Q\) abgeführt als zugeführt, nimmt die innere Energie \(U\) ab, d.h. die Änderung der inneren Energie \(\Delta U\) ist dann negativ.
Tutorial Videos
In der Wärmelehre betrachten wir immer ein abgegrenztes System. Meistens ist im System ein Fluid (Gas oder Flüssigkeit) eingeschlossen.
Das eingeschlossene Fluid hat eine bestimmte Menge an innerer Energie \(U\). Diese kann vergrössert werden, indem wir dem System Arbeit \(W\) zuführen, z.B. indem wir das Fluid mit Hilfe einer Kraft komprimieren, oder indem wir ihm Wärme \(Q\) zuführen, durch Wärmeleitung oder Wärmestrahlung.
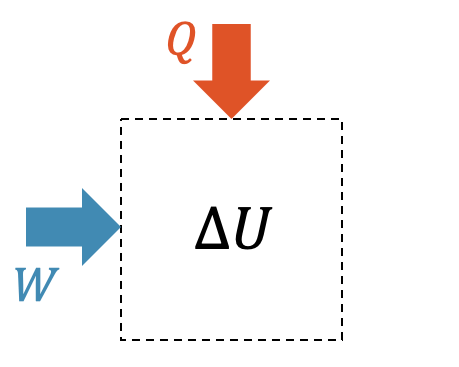
Gase, die schon komprimiert sind, können auch expandieren und so einen Teil ihrer inneren Energie durch Abgabe von Arbeit \(W<0\) an die Umgebung abgeben. Die innere Energie nimmt ab \((\Delta U < 0)\).
Das Gas kann auch schon eine hohe Temperatur haben und somit durch Wärmeabgabe \(Q<0\) an die Umgebung abkühlen.
Der Erste Hauptsatz der Thermodynamik folgt direkt der Energieerhaltung, d.h. die Zunahme der inneren Energie \(\Delta U\) kann nur in dem Masse stattfinden, wie dem betrachteten System Arbeit \(W\) und Wärme \(Q\) zugeführt worden sind:
\[ \Delta U = W + Q \]
Das Vorzeichen der Arbeit \(W\) und der Wärme \(Q\) ist so gewählt, dass eine Zufuhr mit einem positiven Vorzeichen versehen wird und ein Entzug mit einem negativen Vorzeichen.
Jetzt gibt es oft Situationen, wo die Arbeit und die Wärme nicht nur in einer Richtung zu- oder abgeführt wird, sondern beides gleichzeitig stattfindet.
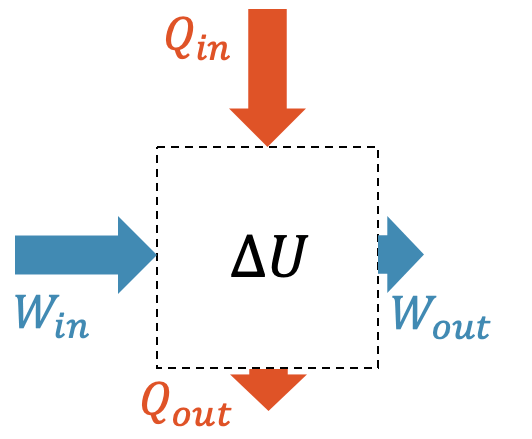
In diesem Fall ist die netto zugeführte Arbeit \(W_{netto}\) die Differenz der zugeführten Arbeit \(W_{in}\) und der abgeführten Arbeit \(W_{out}\):
\[ W = W_{netto} = W_{in} – W_{out} \]
Beachte, dass \(W_{netto}\) damit der Vorzeichenkonvention entspricht, d.h. positives Vorzeichen = Zufuhr zum betrachteten System.
Für die netto zugeführte Wärme gilt das genau gleich:
\[ Q = Q_{netto} = Q_{in} – Q_{out} \]
Wir erhalten damit für die Energieerhaltung:
\[ \Delta U = \big( W_{in} – W_{out} \big) + \big( Q_{in} – Q_{out} \big) \]
Beispiel
Weitere Videos
(keine Aufgaben-Videos zu diesem Thema)
Mini-Test
Um Zugang zum Mini-Test zu kriegen,
musst du vollwertiges Mitglied im Hacker-Club sein.
publiziert:
überarbeitet:
publiziert:
überarbeitet:
Schreib deine Frage / Kommentar hier unten rein. Ich werde sie beantworten.
Inhalt





Schreibe einen Kommentar
Du musst angemeldet sein, um einen Kommentar abzugeben.