Inhalt
Das Wichtigste in Kürze
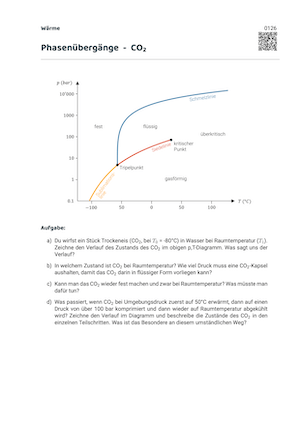
Ein p-T-Diagramm ist eine Darstellung der verschiedenen Aggregatszustände eines Stoffes bei verschiedenen Drücken \(p\) und Temperaturen \(T\). Das p-T-Diagramm enthält:
-
- drei Linien: die Siedelinie, die Schmelzlinie und die Sublimationslinie
- zwei Punkte: den Tripelpunkt und den kritischen Punkt
- drei Gebiete: Das Gebiet des Gases, der Flüssigkeit und des Feststoffs.
Die beiden Gebiete des Gases und der Flüssigkeit sind durch die Siedelinie getrennt. Diese endet aber im kritischen Punkt, d.h. es gibt im überkritischen Gebiet keine scharfe Grenze mehr zwischen Flüssigkeit und Gas.
Partialdruck: Jedes Gas trägt einen Beitrag zum Gesamtdruck bei. Dieser Beitrag ist der Druck, den das Gas alleine im ganzen Volumen haben würde.
Taupunkt: Der Taupunkt ist die Temperatur, bei welcher das Wasser der feuchten Luft auskondensiert und Nebel bildet.
Der Taupunkt ist von der absoluten Feuchtigkeit der Luft, d.h. deren Wassergehalt abhängig. Im Gegensatz dazu ist die relative Feuchtigkeit ein Mass für die Nähe zum Taupunkt. Befinden wir uns im Taupunkt bzw. bei Nebelbildung, so beträgt sie 100%.
Tutorial Videos
(Es gibt leider keine Tutorial Videos zu diesem Thema)
Häufigste Fragen
Aggregatzustände im p-T-Diagramm
Der mittlere atmosphärische Druck auf Meereshöhe beträgt 1.01325 bar \(\approx\) 1 bar. Bei diesem Druck gelten die Temperaturen von 0 °C als Gefrierpunkt und 100 °C als Siedepunkt. Bei Raumtemperatur ist Wasser flüssig.
Ändern wir den Druck, gelten diese Temperaturen nicht mehr: Wir wissen, dass im hohen Gebirge, das Wasser schon unterhalb von 100 °C anfängt zu sieden. Das ist beim Kochen ein Nachteil, denn durch die niedrigere Temperatur braucht das Kochgut länger, bis es gar ist.
Umgekehrt ist es im Dampfkochtopf: Dieser kann einen Druck aufbauen von bis zu 1.8 bar. Der Siedepunkt steigt dadurch auf fast 120 °C ! Das erlaubt ein Kochen bei einer höheren Temperatur, was deutlich schneller geht.
Aus dem p-T-Diagramm kannst Du z.B.herauslesen, dass Wasser bei bei Raumtemperatur (ca. 20 °C) bei einem Druck zwischen 0.01 bar und 0.1 bar.
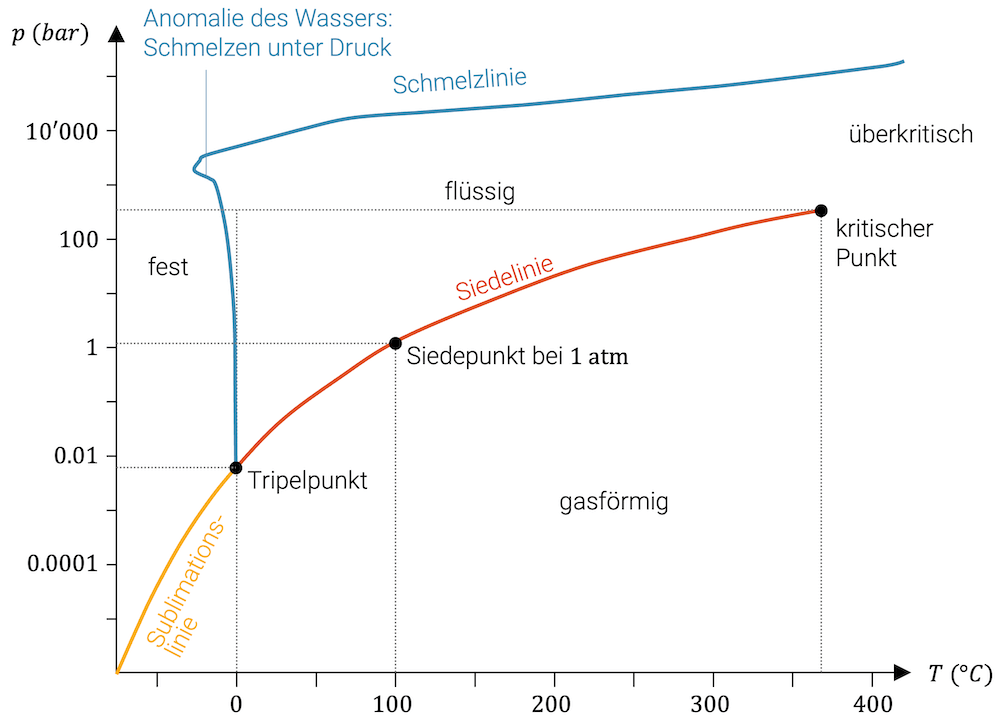
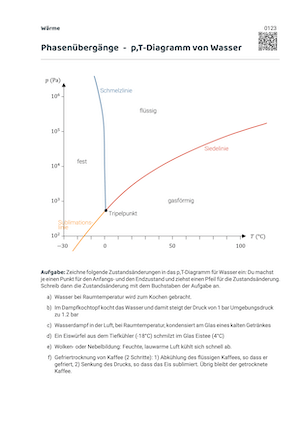
Mit einem p-T-Diagramm für Wasser werden alle möglichen Kombinationen von Druck und Temperatur erfasst. Je nach Kombination haben wir dann festes, flüssiges oder gasförmiges Wasser.
Die Grenzen zwischen den Gebieten der Aggregatzustände sind:
- Die Siedelinie trennt das Gebiet des flüssigen Wassers vom gasförmigen Wasser
- Die Schmelzlinie trennt das Gebiet des flüssigen Wassers von demjenigen des festen Wassereises
- Die Sublimationslinie trennt das Gebiet des gasförmigen Wassers von dem des Wassereises
Die Zustände auf diesen Linien entsprechen Zuständen mit zwei Phasen (zwei gleichzeitigen Aggregatzuständen). ✌️
Ein Phasenübergang ist ein Übergang über eine dieser drei Linien. Wenn wir beispielsweise flüssiges Wasser zum Kochen bringen, starten wir bei 20 °C und einem Druck von einer Atmosphäre 1.01325 bar im flüssigen Gebiet. Wir erhöhen die Temperatur und wandern auf der Horizontalen nach rechts, bis wir die Siedlinie erreichen.
Auf der Siedelinie haben wir beide Aggregatzustände (flüssig und gasförmig) gleichzeitig. Erst wenn wir alles verdampft haben, steigt die Temperatur weiter im gasförmigen Bereich.
Beispiel
- Eis aus dem Tiefkühler
- Eiswürfel im kühlen Getränk
- Wasser bei Raumtemperatur
- Siedendes Wasser
- Nebel bei Raumtemperatur
Tripelpunkt
Beim Tripelpunkt treffen Siedelinie, Schmelzlinie und Sublimationsline zusammen. Während die Linien die Zweiphasenzustände repräsentieren, kommen beim Tripelpunkt alle drei Aggregatzustände gleichzeitig vor.
- Tripelpunkt von Wasser: \(p\) = 6 mbar, \(T\) = 0.01 °C
Beim Tripelpunkt kommen alle drei Linien zusammen. In diesem und nur diesem Punkt können wir den Stoff gleichzeitig in drei Aggregatzuständen vorfinden: im festen, flüssigen und gasförmigen Zustand gleichzeitig.
Der Tripelpunkt ist für uns insofern von Interesse, weil wir dank ihm wissen, ab wann wir mit Sublimation bzw. Resublimation zu rechnen haben. Wir sehen, dass Wassereis unterhalb dieses Drucks und unterhalb der Temperatur des Tripelpunkts sublimiert, d.h. direkt und trocken als Wassereis verdampft, ohne vorher zu schmelzen und zu sieden.
«…weder Gas, noch Flüssigkeit, sondern ein überkritisches Fluid…»
Kritischer Punkt
Der kritische Punkt markiert das obere Ende der Siedelinie.
- Kritischer Punkt von Wasser: \(p\) = 220.64 bar, \(T\) = 373.95 °C
Er liegt bei hoher Temperatur und bei hohem Druck. Einen solchen extremen Zustand kennen wir aus dem Alltag nicht. 😮
Über dem kritischen Punkt, d.h bei Temperaturen über 373.95 °C und bei Drücken über 220.64 bar haben wir weder mit einer Flüssigkeit, noch mit einem Gas zu tun. Ab dem kritischen Punkt gibt es keinen Unterschied mehr zwischen einer Flüssigkeit und einem Gas! Wir reden nur noch von einem überkritischen Fluid. Vorstellen können wir uns eine Art dickflüssiges Gas oder eine sehr dünnflüssige und leichte Flüssigkeit.
«Der Luftdruck entsteht durch die Stösse der Teilchen, die das Gas ausmachen, unabhängig von ihrer Chemie.»
Partialdruck von Wasser in feuchter Luft
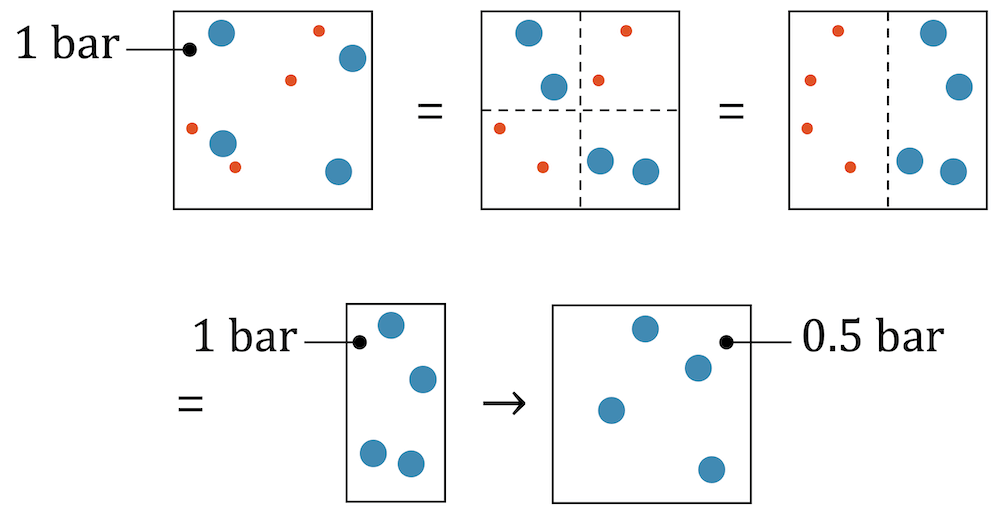
Um den Partialdruck zu verstehen, schauen wir uns ein Zweier-Gasgemisch an mit der gleichen Anzahl Teilchen von jedem Gas. Wir stellen uns dann vor, dass wir die einen Teilchen auf die linke Seite bringen, die anderen Teilchen auf die rechte Seite. Da die Teilchen keine gegenseitige Wechselwirkung haben, spüren die blauen Teilchen keinen Unterschied, ob sie sich in einem doppelt so grossen Behälter befinden, wo sie den Platz mit einem anderen Gas teilen müssen und einem halb so grossen Behälter, ohne zweites Gas. Jedes Teilchen hat in beiden Fällen gleich viel Platz zur Verfügung.
Beim Gasgemisch (ganz links) haben wir einen Druck von \(1\text{bar}\). Ganz rechts haben wir das halbe Volumen, aber insgesamt auch halb so viele Teilchen. Mit dem Gasgesetz von Avogadro folgt, dass das Verhältnis von Volumen \(V\) zu Teilchenzahl \(n\) gleich bleibt, sofern Druck und Temperatur konstant bleiben:
\[ \frac{V_0}{n_0} = \frac{\frac{1}{2}V_0}{\frac{1}{2}n_0} \]
Das ist hier der Fall, d.h. der Druck bleibt konstant. Wir haben ganz links \(1\text{bar}\) und ganz rechts ebenfalls \(1\text{bar}\).
Wenn wir das Volumen rechts wieder verdoppeln, erhalten wir vier blaue Teilchen in einem ganzen Volumen. Gemäss dem Gesetz von Boyle-Mariotte folgt, dass bei konstanter Temperatur und Teilchenmenge eine Verdoppelung des Volumens zu einer Halbierung des Drucks führt:
\[ p_1 V_1 = p_2 V_2 \quad \rightarrow \quad p_2 = \frac{V_1}{V_2} p_1 = \frac{1}{2} p_1 \]
Wenn wir ein ganzes Quadratvolumen mit nur vier blauen Teilchen füllen, dann erzeugen sie nur noch einen Druck von \(0.5\;\text{bar}\). Die gleiche Logik kann aber auch auf das andere Gas mit den roten Teilchen angewendet werden: Vier rote Teilchen im ganzen Volumen würden ebenfalls \(0.5\;\text{bar}\) erzeugen.
Bringen wir beide Gase zusammen, so müssen sie wieder das Volumen mit anderen Teilchen teilen, was eigentlich einer Kompression auf ein halb so grosses Volumen entspricht. Der Druck steigt wieder auf \(1\;\text{bar}\) und wir sind wieder bei der Anfangssituation.
Wir haben unterwegs aber gelernt, dass ein Gas alleine im Volumen nur einen Druck \(0.5\;\text{bar}\) erzeugt. Wir können daraus auch folgern, dass ein Gas für \(0.5\;\text{bar}\) verantwortlich ist und das andere Gas für die anderen \(0.5\;\text{bar}\). Beide zusammen erzeugen deshalb einen Druck von \(1\;\text{bar}\):
\[ p_{\text{blau}} + p_{\text{rot}} = 0.5\;\text{bar} + 0.5\;\text{bar} = 1\;\text{bar} \]
«Jedes Gas trägt einen Beitrag zum Gesamtdruck bei. Dieser Beitrag wird Partialdruck genannt und ist der Druck, den das Gas alleine im ganzen Volumen haben würde.»
Jetzt wenden wir diese Sichtweise auf feuchte Luft an: Luft ist ein Gasgemisch. Neben Stickstoff (\(\text{N}_2\)), Sauerstoff (\(\text{O}_2\)) und Argon (\(\text{Ar}\)) gehört eine kleine Menge Wasser (\(\text{H}_2 \text{O}\)) mit dazu. Warum ist das Wasser bei feuchter Luft im gasförmigen Zustand, obwohl wir uns bei Umgebungsdruck gemäss p-T-Diagramm klar im Bereich des flüssigen Wassers befinden?
Luft kann als ideales Gas modelliert werden. Der Luftdruck entsteht durch die Stösse der Teilchen, die das Gas ausmachen, unabhängig von ihrer Chemie. Wenn wir also 1 bar Luftdruck haben, ist eine gewisse Häufigkeit an Teilchenstössen gemeint, jedoch meistens durch Stickstoff- und Sauerstoffteilchen, die weit häufiger vorkommen als Wasser.
Wasserteilchen können aber nur zusammen mit anderen Wasserteilchen eine Teilchengruppe und damit einen ersten kleinsten Wassertropfen bilden. 🤓
Hätten wir Wasserdampf mit einem Druck von 1 bar, würde dieser bei Raumtemperatur zu flüssigem Wasser kondensieren, gemäss p-T-Diagramm.
In der Luft ist die Wassermenge jedoch nicht ausreichend. Wenn wir uns vorstellen, dass die Wasserteilchen ausschliesslich die anderen Wasserteilchen “sehen”, dann sind sie ziemlich alleine da. Die grossen “leeren” Distanzen zwischen ihnen, verhindern die Bildung eines Flüssigkeitstropfens.
Im p-T-Diagramm können wir die Situation der Wasserteilchen wie ein sehr verdünntes Gas bei einem sehr kleinen Druck vorstellen. Deshalb ist Wasser (in der Luft verdünnt) bei Raumtemperatur im gasförmigen Aggregatzustand.
Die seltenen Teilchenstösse der Wasserteilchen sind äquivalent mit einem sehr geringen Druck. Wenn wir diese wenigen Teilchenstösse an der Zahl aller Teilchenstösse aller Teilchen in der Luft messen, haben wir einen kleinen Beitrag des Wassers am Gesamtdruck. Wir nennen ihn Partialdruck. Er lässt sich berechnen mit der Anzahl Teilchen, verteilt im Gesamtvolumen.
Die Summe aller Partialdrücke ergibt wieder den Gesamtdruck:
\[ p_{\text{N}_2} + p_{\text{O}_2} + p_{\text{Ar}} + p_{\text{H}_2 \text{O}} + … \;\; = \;\; p_{\text{tot}} \approx 1\;\text{bar} \]
Taupunkt
Warum kann in feuchter Luft von \(20\text{°C}\) das Wasser in Form von Wasserdampf vorhanden sein, statt in flüssiger Form?
Die Anzahl Wassermoleküle ist im Vergleich zu den Stickstoff- und Sauerstoffmolekülen in der Luft sehr klein, d.h. der Wasserdampf in der feuchten Luft hat einen sehr kleinen Partialdruck von ein paar \(\text{mbar}\). Dadurch kommen die Wassermoleküle kaum zusammen und können nicht kondensieren. Im p-T-Diagramm für Wasser sind wir bei \(20\text{°C}\) und wenigen \(\text{mbar}\) klar im Gebiet des gasförmigen Wassers.
Wenn die Temperatur etwas kleiner ist und die Anzahl Wassermoleküle grösser ist, können wir durchaus in das Gebiet des flüssigen Wassers gelangen. Dann werden die Wassermoleküle zusammenfinden und sich zu Tropfen vereinen können. Wir beobachten dann die Bildung von Nebel, Dunst oder Wolken.

Der Taupunkt ist die Temperatur, bei welcher das Wasser der feuchten Luft auskondensiert und Nebel bildet.
Der Taupunkt ist von der absoluten Feuchtigkeit der Luft, d.h. deren Wassergehalt abhängig. Im Gegensatz dazu ist die relative Feuchtigkeit ein Mass für die Nähe zum Taupunkt. Befinden wir uns im Taupunkt bzw. bei Nebelbildung, so beträgt sie 100%.
Wir schauen uns dazu drei Beispiele an: Wir kühlen feuchte Luft ab, bis sie Nebel bildet:
- Tropisch feuchte Luft von 35 °C
- Mittelfeuchte Luft von 20 °C
- Feuchte Winterluft von 0 °C
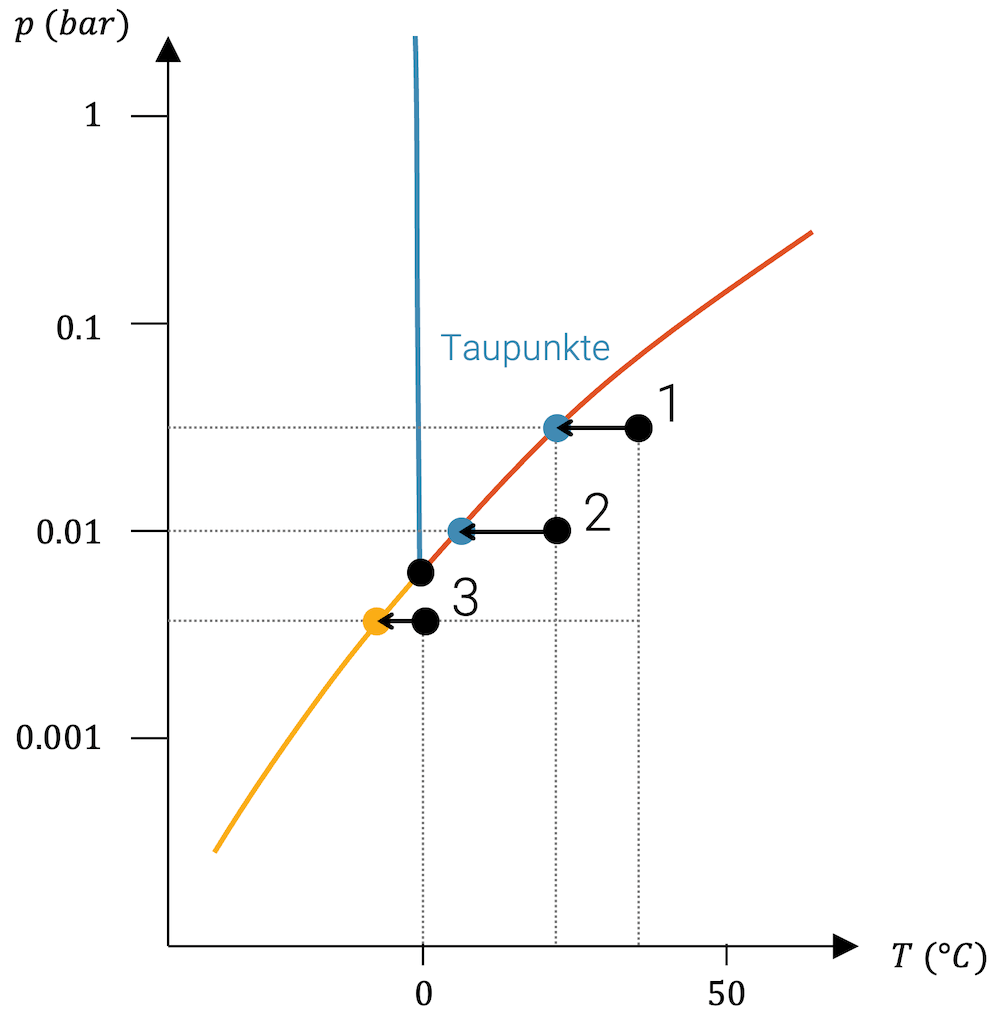
Unsere drei Beispiele haben unterschiedlich hohen Partialdruck, den wir hier nur etwa erahnen können.
Die feuchte Tropenluft hat von allen die höchste absolute Luftfeuchtigkeit. Wenn wir sie abkühlen, bleibt der Partialdruck konstant und die Temperatur nimmt ab, d.h. wir bewegen uns im p-T-Diagramm vom Punkt 1 horizontal nach links. Sobald wir die Siedelinie erreichen, haben wir den Taupunkt, wo die Tropfen- bzw. Nebelbildung einsetzt.
Bei der tropisch feuchten Luft ist das bei vielleicht etwa 20-22 °C der Fall. In den Tropen, v.a. nach einem stark verregneten Vortag gibt es öfters Nebelschwaden am frühen Morgen, wenn die Temperaturen im Bereich von 22-25 °C sind.
Die mittelfeuchte Luft ist ein Beispiel für Luft, die wir in unseren Breiten gut kennen. Sie hat weniger Feuchtigkeit geladen als die tropische Luft, denn sonst wäre sie schon neblig. Wir haben hier einen tieferen Partialdruck. Wir starten im Punkt 2 und bewegen uns nach links, um den Taupunkt zu erreichen. Er könnte z.B. bei etwa 5 °C liegen.
Die Nebelbildung, die wir v.a. im Herbst beobachten, kann mit der Abkühlung von bereits feuchter Luft erklärt werden. Über Nacht kühlt die Luft ab, bildet Nebel, der sich im Verlauf des Tages wieder klärt, wenn die Temperatur über den Taupunkt geklettert ist. Beachte, dass das Wasser in der Luft wegen des sehr tiefen Partialdrucks nahe dem Tripelpunkt ist.
Im dritten Fall ist die Luft nicht nur kühl, sondern schon relativ trocken. Der Partialdruck des Wasserdampfs in der Luft ist so klein, dass wir unter dem Tripelpunkt sind.
Wenn wir jetzt abkühlen erreichen wir nicht die Siedelinie, sondern die Sublimationslinie. Das Wasser resublimiert, d.h. erfährt einen Phasenübergang von der gasförmigen Phase direkt zur festen Phase. Es bilden sich Eiskristalle aus der Luft. Wir kennen dieses Phänomen als Raureif, wenn sich schöne Eiskristalle an den Pflanzen bilden.

Weitere Videos
Aufgabensammlung
Lernziele
Mini-Test
Um Zugang zum Mini-Test zu kriegen,
musst du vollwertiges Mitglied im Hacker-Club sein.
publiziert:
überarbeitet:
publiziert:
überarbeitet:
Schreib deine Frage / Kommentar hier unten rein. Ich werde sie beantworten.
Inhalt






Schreibe einen Kommentar
Du musst angemeldet sein, um einen Kommentar abzugeben.