Inhalt
Mit seinem Experiment konnte Millikan im Jahre 1909 die Ladung der Elektronen und damit die kleinste mögliche Menge an Ladung, die Elementarladung, bestimmen. Robert Andrews Millikan (1868 – 1953) war ein amerikanischer Physiker. Das Experiment an sich ist sehr interessant und die Art und Weise, wie die Elementarladung bestimmt werden konnte ist sehr clever.
Millikan versprühte feinste Öltröpfchen in einen Behälter. Die schwebenden Tröpfen sanken langsam ab und einige davon konnten durch ein Loch in den unteren Bereich des Behälters absinken. Es entstand eine Kette von einzelnen Öltröpfchen, die langsam nach unten sanken.
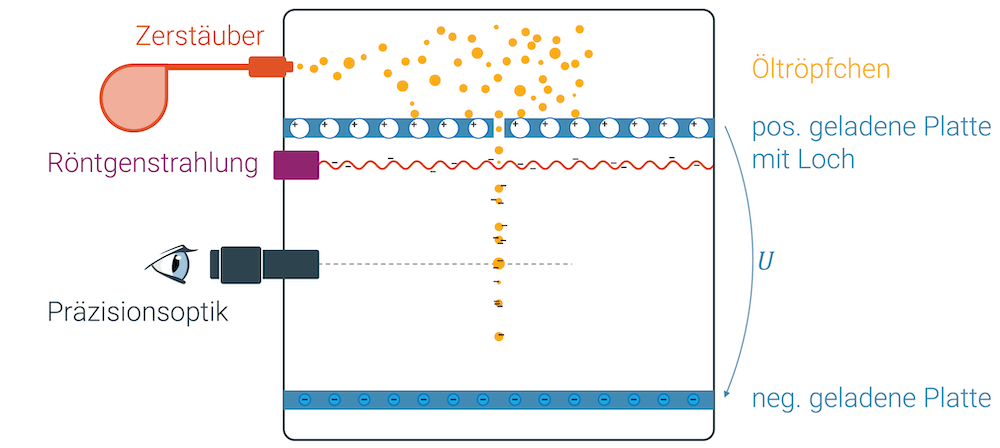
Mit einer Röntgenstrahlung konnte er die schwebenden Tröpfchen elektrisch laden. Röntgenstrahlung gehört zu den ionisierenden Strahlen, d.h. es sind elektromagnetische Wellen, die genügend Energie bzw. Impuls haben, um die Atome der Luft durch einen Stossprozess von einem ihrer Elektronen zu befreien. Die freien Elektronen treffen auf das Öltröpfchen und geben ihm eine negative Ladung.
Millikan wusste nicht, wie viele Elektronen die Tröpfchen aufgenommen hatten und auch nicht, wie gross die Ladung der Tröpfchen war. Er platzierte aber zwei Platten über und unter den Tröpfchen und stellte eine elektrische Spannung ein. Das ist wie, wenn er die Platten elektrisch geladen hätte: Die obere Platte wurde positiv geladen, die untere Platte negativ.
Die negativ geladenen Tröpfchen standen jetzt unter dem Einfluss von zwei sich konkurrierenden Kräften: Die Gewichtskraft zog die Tröpfchen nach unten. Die elektrische Kraft aufgrund der Ladung (Coulombkraft) zog die Tröpfchen nach oben. Er konnte die elektrische Spannung so einstellen, bis die Tröpfchen im Kräftegleichgewicht waren (\(F_{res}=0\)) und auf konstanter Höhe schwebten.
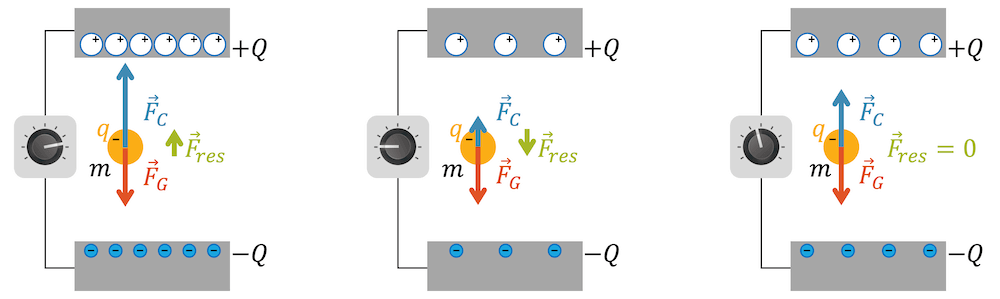
Nicht alle Tröpfchen schwebten! Die einen waren zu schwer oder zu wenig geladen, die anderen waren zu leicht oder zu stark geladen, oder beides. Er konnte aber anhand der sichtbaren Grösse der Tröpfchen, deren Volumen und damit auch deren Masse berechnen.
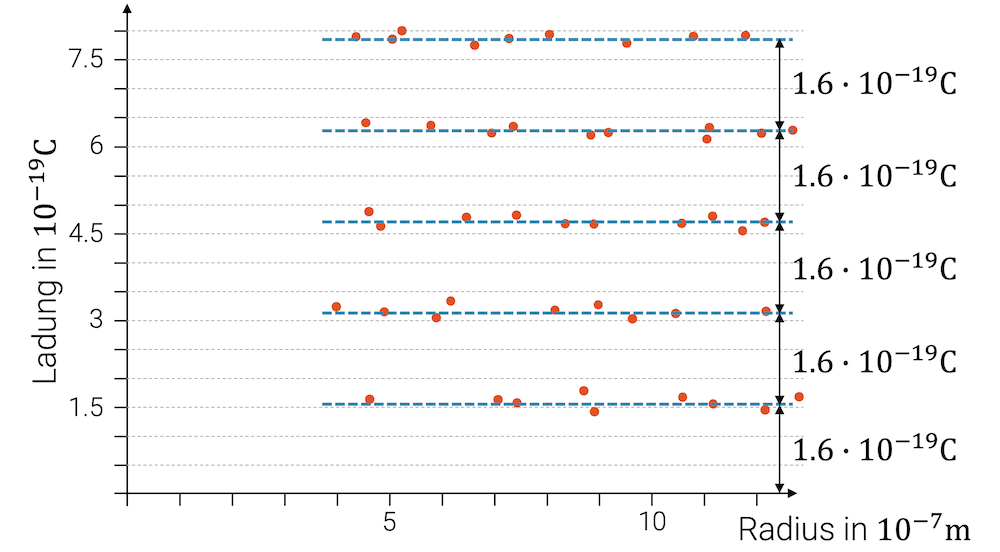
Er konnte aber schliesslich zeigen, dass Tröpfchen von verschiedenen Grössen nicht alle erdenklichen elektrischen Ladungsmengen aufwiesen, sondern nur genau Vielfache der Ladung \(e=1.6\cdot10^{-19}\,\text{C}\). Er hatte damit die Elementarladung des Elektrons gefunden.
publiziert:
überarbeitet:
publiziert:
überarbeitet:
Schreib deine Frage / Kommentar hier unten rein. Ich werde sie beantworten.
Inhalt





Schreibe einen Kommentar
Du musst angemeldet sein, um einen Kommentar abzugeben.